
[ESMO ASIA 2022(싱가포르) = 황재선 기자] O Lazertinib de Yuhan (Nome do produto: Lexraza) aumentou a sobrevida livre de progressão mediana em mais do que o dobro do Gefitinib (Nome do produto: Iressa) em um ensaio clínico de primeira linha para câncer de pulmão de células não pequenas EGFR avançado mutado.
O professor Cho Byung-cheol do Yonsei Cancer Center apresentou os resultados da análise hepática do ensaio clínico global de Fase III de LAzertinib (LASER301) na sessão ESMO ASIA 2022 “Presidential Symposium” no dia 3.
“Lazertinib é o primeiro tratamento desenvolvido domesticamente para câncer de pulmão de células não pequenas (NSCLC) com mutação EGFR a concluir um ensaio clínico global de fase III”, disse o professor Byung-chul Cho. perfil de segurança. “.

Lazertinib é uma terapia de direcionamento de EGFR-TKI (inibidor de tirosina quinase) de terceira geração que visa tanto o EGFR T790M quanto mutações alérgicas.
A equipe de pesquisa do professor Byung-chul Cho teve como alvo adultos com mutação progressiva do EGFR (Ex19del/L858R) NSCLC que não tinham experiência anterior com EGFR-TKI ou experiência com quimioterapia sistêmica. Os pacientes que tinham metástase no SNC, mas estavam neurologicamente estáveis, foram direcionados, completaram o tratamento e terapia com esteroides por 2 semanas.
Os pacientes receberam 240 mg de lisretinibe oral diariamente, e o grupo controle recebeu 250 mg de gefitinibe. Eles foram designados aleatoriamente em uma proporção de 1:1 de acordo com a mutação e etnia.
A equipe de pesquisa designou o índice de validação primário como PFS (Progress-Free Survival) calculado usando RECIST v1.1.
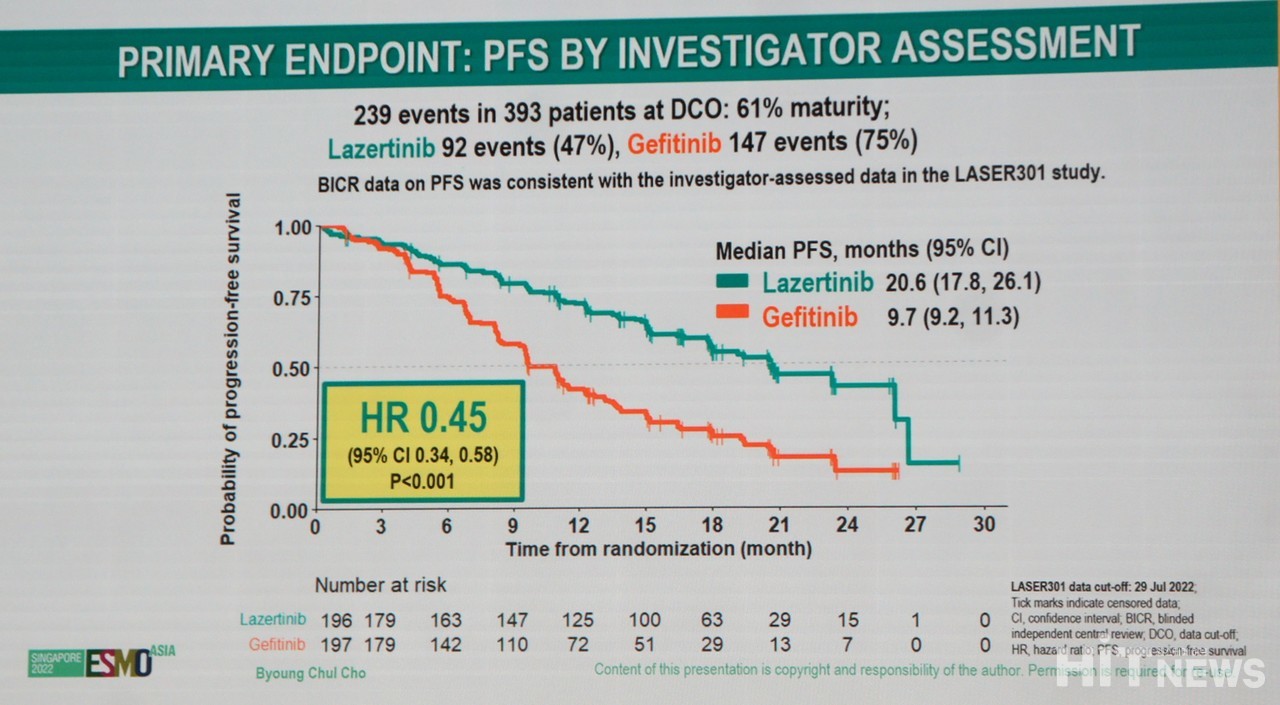
393 pacientes foram randomizados, generalizados e operados em 96 locais em 13 países (196 pacientes no grupo lasertinibe e 197 pacientes no grupo gefitinibe). Em particular, a sobrevida livre de progressão mediana foi maior com Lazertinib (20,6 meses) do que com Gefitinib (9,7 meses). Além disso, o HR (taxa de risco, intervalo de confiança de 95%) para progressão da doença ou morte foi de 0,45 (0,34–0,58).
A vantagem de sobrevida livre de progressão (PFS) do lazertinibe sobre o gefitinibe foi consistente em todos os subgrupos.
A sobrevida livre de progressão mediana foi de 20,6 meses e 9,7 meses para gefitinibe, 9,7 meses para gefitinibe e 9,7 meses para gefitinibe e Lexraza entre não asiáticos, respectivamente.
Lazertinib durou 20,7 meses e Gefitinib 10,8 meses em pacientes com a mutação Ex19del e 17,8 meses e 9,6 meses em pacientes com a mutação L858R, respectivamente.
A taxa de resposta objetiva (ORR) foi de 76% (intervalo de confiança de 95%, 0,62–1,59) em ambos os grupos, e a duração média da resposta (DOR) foi de 19,4 meses e 8,3 meses.
O professor Byung-chul Cho disse: “Na análise interina, os dados sobre a sobrevida global (OS) não foram adequadamente acompanhados. A taxa de sobrevida de 18 meses foi maior com Lazertinib (80%) do que com Gefitinib (72%)”. risco de morte é de 0,74″.
Enquanto isso, o olmotinib, medicamento da Hanmi Pharm, que funciona pelo mesmo mecanismo, obteve aprovação local no passado, mas a aprovação foi retirada devido a questões de segurança. Consequentemente, especialistas da indústria classificam o larsitinibe como o primeiro novo medicamento na Coréia que demonstrou eficácia e segurança por meio de testes confirmatórios.

“Leitor implacável. Especialista em mídia social. Amante de cerveja. Fanático por comida. Defensor de zumbis. Aficionado por bacon. Praticante da web.”
